서론
최근 신재생 에너지에 대한 관심과 필요성이 대두되고 있으나 원유 및 석유 관련 제품에 대한 의존성은 전 세계적으로 여전히 높은 실정이다. 따라서 신재생 에너지가 기존의 원유 기반 산업을 안정적으로 대체하기 전 까지는 원유 생산성의 극대화 및 회수 효율의 증대에 관한 연구가 지속적으로 이루어져야만 한다. 또한 원유 생산이 환경에 미치는 부정적 영향을 최소화하기 위한 노력도 함께 수행되어야만 한다.
회수증진공법(enhanced oil recovery; EOR) 중 화학공법은 폴리머, 계면활성제, 유화제 등의 화학물질을 수공법과 결합하여 오일 생산성을 크게 증가시키는 방법이다. 화학공법에 사용되는 물질은 주로 합성 물질을 원료로 만들어지는데 비이온성 계면활성제 제조에 사용되는 산화에틸렌(ethylene oxide)이 대표적인 예다(Lynch et al., 1984; Desbene et al., 1987). 이러한 화학물질은 그 자체로 지중 환경에 악영향을 미칠 가능성이 있으며 오일과 공존하는 환경에서 그 위험성은 더욱 증가한다(Mulligan et al., 2001; Rico-Martínez et al., 2013).
화학공법의 잠재적 위험성에 따라 친환경적이고 경제적인 대체 기술에 대한 관심이 증가하고 있다. 대체 기술로 주목받고 있는 기술 중 하나는 미생물 및 그 생성물을 회수증진공법에 이용하는 것이다(Belyaev et al., 2004). 미생물 회수증진공법(microbial enhanced oil recovery; MEOR)은 미생물로부터 생성되는 생성물(바이오폴리머, 생계면활성제, 바이오필름 등)을 이용하여 오일의 회수효율을 증가시키는 기술이다. 미생물을 이용하는 공법의 특성상 저렴한 가격의 영양물질 공급을 통해 생분해가 가능한 비독성 바이오생성물을 얻을 수 있으므로 기존의 회수증진공법에 비해 경제적이면서도 친환경적이다. 또한, 화학공법에 사용되는 화학물질이 주로 석유기반제품임을 고려할 때 미생물공법은 유가 변동에 큰 영향을 받지 않는다는 경제적 이점을 가지고 있다(Sen, 2008).
저류층 내에 존재하는 생물학적 시스템은 매우 복잡하기 때문에 주입된 미생물은 고유 미생물군과의 경쟁을 하게 되며 실험을 통한 미생물의 활성도 도출 또한 쉽지 않다(Sen, 2008). 실험만으로는 미생물공법의 회수증진 효과를 예측하기 어렵기 때문에 기존에 수행된 미생물공법 프로젝트에 대한 자료를 토대로 미래를 분석하기도 한다. 탄화수소 소모 박테리아(hydrocarbon-utilizing bacteria)를 활용한 미생물공법들의 기술 효율성 및 경제성을 분석하기 위해 322개의 프로젝트를 분석한 바 있으며(Portwood, 1995), 그 결과 오일 회수율에 차이를 보였다. Sen (2008)에 따르면 오일의 회수율에 영향을 미치는 요소로는 암질(lithology), 공극률, 투과도, 저류층 온도, 오일 비중 등이 있다.
회수율에 영향을 미치는 저류층 환경에 합당한 미생물공법을 적용해야 한다. 배유영역 내 고투과층 존재에 의한 접촉효율(sweep efficiency)의 저하 문제를 완화시키기 위해서는 바이오필름에 의한 선택적 공극막힘(selective plugging) 전략을 사용한다(Bryant, 1987; Yakimov et al., 1997; Lazar et al., 2007; Sen, 2008; Ohms et al., 2010; Zheng et al., 2012; Okeke and Lane, 2012). 생계면활성제를 이용하면 물과 오일 간의 계면장력을 감소시켜 오일 회수율을 증가시킬 수 있다(Li et al., 2002; Lazar et al., 2007; Sen, 2008; Pornsunthorntawee et al., 2008; Ghojavand et al., 2012; Zheng et al., 2012; Gudina et al., 2012). 바이오폴리머의 경우 주입수의 점도를 증가시켜 저류층 내 유체 간 유동도비를 개선시켜 오일 회수에 적합한 환경을 형성한다(Bryant, 1990; Healy et al., 1996; Pornsunthorntawee et al., 2008; Sen, 2008; Lal et al., 2009). 또한 미생물을 이용하여 오일 내 알킬 체인을 분해하여 오일 점도를 낮추는 방법, 미생물 대사활동의 부산물로 발생하는 기체를 통한 압력 보강 등이 미생물공법의 메커니즘으로 활용되고 있다(Kowalewski et al., 2006; Bao et al., 2009; Xu and Lu, 2011; Gudina et al., 2012; Zheng et al., 2012).
본 논문에서는 미생물 회수증진공법에 대한 대략적인 소개와 그 적용 사례에 대해 설명하고자 한다. 미생물공법을 적용할 때 선택할 수 있는 주입 전략과 성공 가능성이 높은 저류층 환경 범위를 제시하였다. 또한 오일 회수에 영향을 줄 수 있는 미생물 및 바이오생성물의 메커니즘에 대하여 설명하였다. 특히 바이오매스 및 바이오폴리머에 의한 선택적 공극막힘, 생계면활성제에 의한 습윤도 변화, 바이오산에 의한 암석 용해, 미생물에 의한 오일 분해에 대하여 설명하였다. 그 후 세계적으로 현장에 적용된 미생물공법과 성공가능성에 대해 분석하였다.
미생물공법의 적용 범위
미생물공법의 초기 개념은 1926년 Beckman이 처음 제안하였으며 이후 ZoBell이 황산환원세균(sulfate-reducing bacteria)을 이용한 회수증진 방안을 제안하였다(Beckman, 1926; ZoBell, 1947; Lazar et al., 1999). 최근의 연구는 비원위치(ex-situ) 및 원위치(in-situ) 조건에서의 미생물공법 적용 시 생산성 증대 효과에 그 초점을 맞추고 있다. 비원위치 공법은 지표 환경에서 목적 바이오생성물을 생성한 뒤 유정을 통해 주입하는 방식이다. 이 방법은 저류층 운영자가 생성물의 구성요소 및 화학성분 등을 취사선택 가능하다는 강점을 가지며 실험을 통해 회수능력이 좋은 미생물을 선별, 가공하여 사용한다. 이때 목적 생성물을 미생물로부터 추출하여 물과 함께 주입하거나 다른 화학 물질과 함께 주입한다. 혹은 실험실에서 배양한 미생물을 저류층에 직접 주입하여 목적으로 하는 물질이 생성되도록 유도한다.
운영자에 의한 직접적인 제어가 가능하다는 점에서 비원위치 공법은 일견 타당해 보이지만 우려할 점 또한 존재한다. 우선 비원위치 공법은 원위치 공법에 비해 목적 바이오생성물을 생성하는데 많은 비용이 든다. 덜 정제된 바이오생성물을 사용하면 비용을 크게 절감할 수 있으나 비원위치 공법에 드는 비용은 필수적으로 고려되어야만 한다(Pornsunthorntawee et al., 2008; Zheng et al., 2012). 또한 비원위치 공법에 사용하는 미생물이 저류층 내 고유 미생물에 비해 우수한 성능을 가져야만 하지만 대부분의 경우 그렇지 못하다.
비원위치 공법이 실험실 환경에서 제어 가능한 공법인데 반해 원위치 공법은 현장에 직접 적용하여 회수증진 효과를 확인해야만 한다. 원위치 공법은 저류층 내 고유 미생물을 자극하여 원하는 바이오생성물을 생성하도록 유도한다. 저렴한 영양물질을 주입한 뒤 고유 미생물을 자극하여 생계면활성제나 바이오폴리머, 바이오필름, 바이오솔벤트와 같은 바이오생성물을 생성한다. 원위치 공법 및 비원위치 공법 모두 잠재력 있는 공법이며 경우에 따라 두 가지 공법을 동시에 고려할 수도 있다. 하지만 기존 연구들을 고려할 때 원위치 공법이 석유산업 현장에서 더 중요한 위치를 차지하고 있다(Sen, 2008; Bao et al., 2009; Gudina et al., 2012; Youssef et al., 2013).
공법의 특수성으로 인해 미생물공법은 특정 환경에서 그 성공 가능성이 높으며 대부분 생산성이 크게 감소한 유정(< 10 bbl/day)을 대상으로 적용한다. DOE reservoir data와 Institute of Reservoir Studies (IRS)는 미생물공법을 적용하기에 적합한 저류층 조건을 Table 1과 같이 정리하였다(Patel et al., 2015).
미생물공법은 크게 두 가지 방법으로 현장에 적용된다. 그 중 미생물 유정자극법(microbial well stimulation) 혹은 주기적 미생물 회수공법(cyclic microbial recovery, CMR)은 전 세계적으로 상용화된 공법이다. CMR 공법은 미생물과 영양물질을 주입정을 통해 저류층에 주입한다. 이후 주입정을 폐쇄하여 미생물을 생장시키고 이 과정에서 발생하는 CO2 가스와 계면활성제를 이용하여 오일의 유동성을 높인다. 그 후 유정을 다시 개방하여 미생물로 인해 발생한 부산물과 함께 오일을 생산한다. 이러한 CMR 공법은 여러 번 반복적으로 수행된다. 이 방법은 파라핀 및 아스팔텐 침전으로 문제를 겪고 있는 오일 저류층을 주 대상으로 적용하며 미국, 베네수엘라, 중국, 인도네시아 및 인도 일부 지역에서 적용되고 있다.
또 다른 미생물 회수증진공법 중 하나는 미생물 증진 수공법(microbial enhanced waterflooding) 혹은 미생물공법(microbial flooding recovery, MFR)이다. MFR 공법은 저류층 심부까지 영양물질을 유동시키기 위한 방법이며 아직까지 연구를 진행 중인 기술이다. 보통 수공법이 적용된 저류층에 미생물 및 영양물질을 주입하며 이때 발생하는 바이오 생성물을 이용하여 회수된 오일을 생산정에서 생산해 낸다.
Table 1. MEOR screening criteria
미생물공법의 유형
바이오매스
회수공법을 적용할 때 생산성을 떨어뜨리는 가장 큰 환경적 요인 중 하나는 배유영역 내 존재하는 고투과도층의 존재이다. 수공법 적용 시 고투과도층에 의해 물의 유동 채널이 형성되고 조기 돌파(early breakthrough) 현상이 발생한다. 이러한 현상이 발생하면 물과 오일 간 접촉효율이 떨어지고 회수율이 감소하게 된다. 선택적 공극막힘 현상을 이용한 미생물공법은 바이오매스 또는 바이오폴리머를 이용하여 저류층 내 고투과도층의 공극을 막아 주입수의 유동 경로를 우회시켜 접촉효율을 증가시킨다.
저류층 내 고유미생물이 생장할 때 암체 내 공간을 차지하게 되며 세포막 표면 분자에 의해 주입된 영양물질 주변으로 들러붙게 된다. 결국 공극 내 미생물은 자체적으로 생장하여 바이오필름을 생성한다(Karimi et al., 2012). 이러한 공극막힘 현상은 고유 미생물을 자극하거나 선별된 미생물을 주입하는 방식으로 유도할 수 있으며 미생물 생장 과정에서 발생하는 바이오폴리머 또한 본 현상에 크게 관여한다.
바이오매스를 이용한 공극막힘 현상은 고투과도 채널을 막아 접촉효율을 증가시킬 뿐만 아니라(Satyanarayana et al., 2012) 암체 표면의 습윤도를 오일 생산에 유리한 환경으로 변화시킨다(Karimi et al., 2012). 다양한 미생물종을 대상으로 선택적 공극막힘 현상에 대한 연구가 수행되었으며 성공적인 적용을 위한 네 가지 조건을 제시하였다(Jenneman, 1989). 우선 적용 미생물이 공극을 통해 유동이 가능해야 하며 미생물 생장에 필요한 적절한 영양물질이 공급되어야 한다. 이때 생장한 미생물은 회수증진에 필요한 적절한 바이오생성물을 생성해야 하며 미생물의 생장속도가 너무 빨라 유정을 막는 현상이 발생해서는 안 된다. 선행 연구에 따르면 Bacillus licheniformis BNP29 종을 저투과도 코어에 주입하였을 때 위의 네 가지 조건을 모두 충족시켰으며 미생물공법에 적절한 바이오생성물을 생성하였다(Yakimov et al., 1997). 반면에 황산환원세균종의 경우 비선택적 공극막힘 현상(non-selective plugging)을 유발하며, 유정에 악영향을 미치는 부산물을 생성하기 때문에 미생물공법을 적용할 때 주의해야 한다. 이처럼 미생물공법을 실제 현장에 적용하기 위해서는 저류층에 존재하는 모든 고유 미생물을 자극하기보다는 목표 미생물만을 선택적으로 자극하여 원하는 바이오생성물을 생성시키는 것이 무엇보다 중요하다.
바이오폴리머
Xanthomonous, Aureobasidium, Bacillus 등 다양한 미생물종이 회수증진공법에 사용가능한 폴리머를 생성하는 것으로 알려져 있다(Sen, 2008). 그 중 주요 바이오폴리머로는 xanthan gum과 curdlan을 들 수 있다. Xanthan gum은 식품, 화장품, 화학 및 석유 산업 등에서 다양한 용도로 널리 사용되고 있다(Palaniraj and Jayaraman, 2011). 시추 작업에 사용 가능할 정도로 열과 염도에 대한 내구성이 높아 많은 연구자들이 돌연변이종을 개발하거나 저렴한 영양물질을 이용해 생성하고자 하였다(Kurbanoglu and Kurbanoglu, 2007; Rottava et al., 2009; Palaniraj and Jayaraman, 2011). Xanthan gum은 보통 주입수에 직접 혼합하여 저류층에 주입되며 주입수의 점도를 높여 오일과의 유동도비를 개선시켜주는 효과를 기대할 수 있다. 또한 저류층 내 미생물을 자극하는 방법으로 해당 폴리머를 생성해 내기도 한다.
Curdlan 또한 미생물공법에 사용가능한 바이오폴리머로, 암석의 투과도를 감소시키는 역할을 한다. Curdlan과 유산균을 배합하여 Berea 사암 코어에 주입하는 실험을 수행한 연구 결과에 따르면 코어의 투과도가 850 md에서 2.99 md로, 904 md에서 4.86 md로 감소되었다(Fink, 2011).
바이오폴리머는 고유 미생물을 자극하여 생성하는 방법보다 주입수에 직접 혼합하여 적용하는 경우가 더 일반적이다(Fox et al., 2003). 또한 생성된 바이오폴리머는 바이오매스와 결합되어 저류층 투과도를 감소시키는 역할을 한다.
생계면활성제
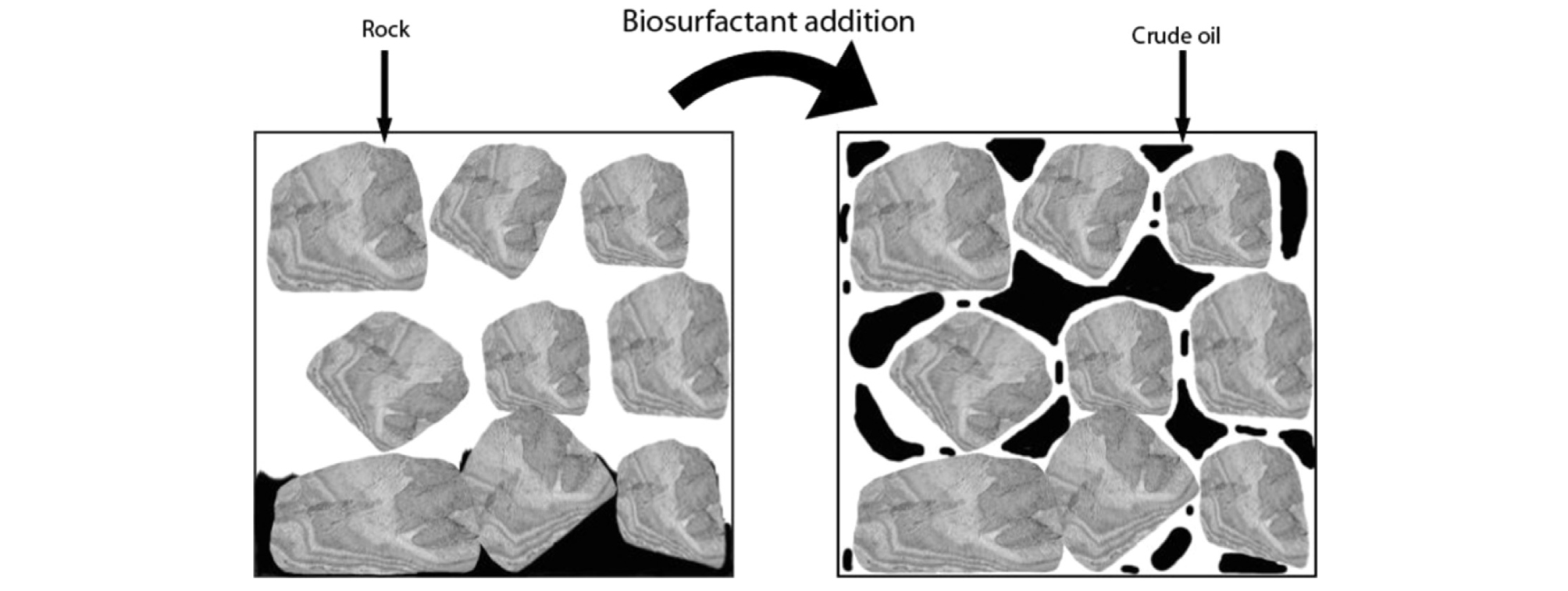
대부분의 저류층은 수습윤성(water-wet)이 아닌 유습윤성(oil-wet) 또는 혼화습윤성(mixed-wet) 특징을 가지고 있다(Salehi et al., 2008). 이러한 특성으로 인해 오일이 암석에 흡착되어 대체효율(displacement efficiency)이 낮아져 오일 회수에 어려움을 준다. 미생물이 생성한 생계면활성제는 저류층 암석의 수습윤성 또는 혼화습윤성 때문에 발생한 공극 내 갇힘 문제를 해결할 수 있다(Vaz et al., 2012). 생계면활성제는 표면장력과 계면장력을 감소시킨다(Sivasankar and Govindarajan, 2016). 생계면활성제를 통해 감소한 계면장력은 오일의 흡착에도 영향을 미친다. 다수의 연구들이 이러한 계면장력의 변화 메커니즘에 주목하였으며 오일 회수율의 증가를 보여주었다(Sen, 1997; Makkar and Cameotra, 1998; Illias et al., 1999; Almeida et al., 2004; Behesht et al., 2008; Amani et al., 2010; Bueltemeier et al., 2014; Sivasankar and Govindarajan, 2015; Daryasafar et al., 2016; Hosseininoosheri et al., 2016). 생계면활성제에 의해 물과 오일 간의 계면장력이 바뀌는 메커니즘은 다음 Fig. 1과 같이 간단히 나타낼 수 있다(Patel et al., 2015). Fig. 1에서 확인할 수 있듯이, 계면활성제는 물과 함께 주입됨에 따라 물과 오일간 혼화성을 증가시키고 공극 내 갇힌 오일을 움직이도록 도와준다. 이는 결국 공극 내 유동 변화를 발생시키기 때문에 오일 회수율에 긍정적인 효과를 줄 수 있다.
미생물공법에 가장 효과적이라고 알려진 생계면활성제 lipopeptides는 Bacillus subtilis나 Pseudomonas를 통해 생성된다. 해당 생계면활성제의 회수증진 효과는 다수의 코어 규모 실험 연구에서 확인할 수 있다(Schaller et al., 2004; Karimi et al., 2012; Al-Wahaibi et al., 2014). 한 연구에서는 실험을 통해 물의 표면장력이 lipopeptides를 적용함에 따라 72에서 27.9 mN/m까지 감소하는 것을 확인했다(Sen and Swaminathan, 2005).
현재까지 생계면활성제 중 가장 많은 연구가 행해진 rhamnolipids는 Psuedomonas aerouginosa라는 미생물을 통해 생성 되며, 미생물의 생장을 돕는 바이오필름도 생성한다고 알려져 있다(Glick et al., 2010). Lipopeptides와 마찬가지로 물과 오일 간 계면장력을 0.1 mN/m 까지 낮출 수 있기 때문에 미생물공법 적용 시 고려되는 주요 종이다(Youssef et al., 2009).
실험실 규모의 선행연구에 따르면 원위치 생계면활성제 적용 공법은 수공법 대비 최대 15% 이상까지 회수율을 개선시킬 수 있다(Daryasafar et al., 2016). 기존 타공법 대비 높은 수치는 아니지만 친환경적이며 경제적이라는 특성을 생각할 때 합리적인 수치로 볼 수 있다.
원위치 미생물공법의 효율을 극대화하기 위한 수학적 모델링 연구도 행해지고 있다. 수많은 연구들이 3차원과 다상 수치 모델 기반의 생물역학 모델이 석유 산업에서 필요함을 주장하고 있다(Behesht et al., 2008; Bueltemeier et al., 2014). 특히 미생물공법은 환경적 요인을 정량적으로 활용하기 위한 수치화 연구도 필요하다(Sivasankar and Govindarajan, 2015; Hosseininoosheri et al., 2016). 미생물공법의 환경 요인을 수치화하고 이를 분석하는 것이 중요하며 최적의 주입 설계 또한 필요하다. 이처럼 원위치 미생물공법의 현장 유효성을 확인하기 위한 연구가 지속적으로 이루어지고 있으며, 자극하는 미생물로부터 생성되는 생계면활성제의 특성을 파악하기 위해 추가적인 연구도 필요하다.
바이오산/솔벤트/가스
미생물이 생성하는 바이오산(bio acid), 솔벤트(solvent), 가스는 탄산염암에서의 회수 효율을 향상시키는데 중요한 역할을 한다. 특히 미생물에 의해 생성된 바이오산은 저류암인 탄산염암의 일부를 용해시켜 오일 회수율을 증가시키는 효과를 가지고 있다(Lazar et al., 2007; Sen, 2008). 이는 선택적 공극막힘이나 습윤도 변화와 같은 메커니즘과 달리 수공법에 악영향을 주는 저류암 자체의 특성을 제거한다는 차이점이 있다. 비슷한 방식으로 아세톤이나 에탄올과 같은 바이오솔벤트 또한 탄산염암을 용해시킬 수 있다(Bryant, 1987). 즉, 미생물이 생성한 바이오산이나 바이오솔벤트는 암석 용해에 따라 공극률과 투과도를 변화시켜 공극 내 갇힌 오일을 회수한다.
전통적으로 압력 상승효과를 통해 저하된 저류층의 생산 능력을 회복시키는 회수증진공법이 있다. 메탄이나 이산화탄소 등의 가스를 생성하는 미생물을 통해서도 이러한 메커니즘을 실현할 수 있다(Sen, 2008). 일반적으로 가스를 생성하는 미생물은 바이오산이나 솔벤트도 생성할 수 있기 때문에 저류층 압력 증가와 더불어 저류암 용해 또한 유도할 수 있다(Lazar et al., 2007; Sen, 2008). 생성된 가스는 오일에 용해되어 오일의 점도를 감소시키기 때문에 물과 오일 간 유동도비를 개선시키는 효과도 가진다.
바이오산, 솔벤트, 가스를 활용한 미생물 회수증진공법의 효용성은 실험실 규모에서 검증되고 있다. 바이오산은 아세테이트 또는 낙산(butyrate)을 생성한다고 알려진 미생물 Clostridium이나 생계면활성제 생성과 동시에 산을 생성하는 미생물 Bacillus를 사용해 연구되어 왔다. 미생물 Zymomonas mobilis와 Clostridium acetobutylicum, Clostridium pasteurianum 등은 바이오솔벤트를 생성하며 회수증진 효과를 나타낼 수 있다고 평가된다(Bryant, 1990). 그러나 미생물에 의한 에탄올 생성은 여전히 연구되고 있는 기술이기 때문에 아직 저류층에 직접 주입할 만큼의 양을 생성하는 것은 불가능하다. 하지만 화학적 솔벤트가 있는 조건에서 생장할 수 있는 미생물을 활용한다면 화학공법에 더하여 추가적인 회수를 얻을 수 있을 것이다(Kieboom et al., 1998).
미생물의 오일 분해
오일 저류층에 존재하는 미생물 중 일부는 탄화수소를 에너지원으로 소모하며 생장을 이어간다. 이 과정에서 미생물은 중질유에 있는 알킬 체인을 분해하여 경질유의 비율을 증가시킨다(Sen, 2008; Gudina et al., 2012). 이렇게 만들어진 경질유는 점도가 낮아 이후 적용 될 공법에서 오일 회수에 유리한 환경을 형성한다. 실험에서 Bacillus subtilis의 특정 종은 40°C 환경에서 오일 분해능을 보이기도 하였다(Gudina et al., 2012). 이러한 오일 분해 능력을 이용한 미생물공법은 석유 산업에 있어 가장 매력적이며 실용적인 기술로 여겨진다. 오일 분해 미생물은 원위치 및 비원위치 공법으로 적용 가능하며, 석유산업의 다양한 측면에서도 활용 가능하다. 예를 들어 오일 추출 과정에서 발생하는 유해 폐기물 및 슬러지 등을 분해하는데 활용할 수 있는 친환경적이고 경제적인 방법이다(Yan et al., 2012).
왁스 침전물을 제거하기 위한 수단으로 오일 분해 미생물을 현장에 적용한 바 있으며(Spormann and Widdel, 2000; Van Hamme et al., 2003; Zhang et al., 2012; Zheng et al., 2012) 알킬 체인 분해 능력을 이용한 회수증진을 목적으로 적용되기도 하였다. 중국 Daqang 유전의 Kongdian 저류층을 대상으로 오일 분해 미생물 자극공법이 수행된 바 있다. 호기성의 오일 분해 미생물을 자극하기 위해 산소를 녹인 물을 주입하였으며 이를 통해 저류층 내 중질유의 비율을 낮추고자 하였다(Nazina et al., 2007). 또한, 해당 미생물을 이용하여 파이프 내 오일 유동을 개선할 수 있다(Perfumo et al., 2010).
미생물공법의 현장 적용 현황
미생물 회수증진공법은 1950년대 중반 이래로 미국, 동유럽, 러시아, 네덜란드 등에서 현장 적용이 이루어졌다(Hitzman, 1982; Hitzman 1988). 특히 1970년의 석유 위기는 많은 나라가 미생물공법 연구에 대해 큰 관심을 가지게 되는 계기가 되었다. 미생물공법은 주로 육상 사암 저류층에 적용되었으며 매우 드물게 균열이 있는 탄산염암 저류층이나 해상 유전에서 그 효용성이 평가되었다(Awan et al., 2008, Rassenfoss, 2011). Table 2는 미생물공법의 현장 적용 사례를 국가별로 정리한 것이다.
Table 2. Worldwide field applications of MEOR
최초로 미생물공법이 적용된 현장은 미국의 Lisbon 유전이다(Hitzman, 1982; Grula and Russell, 1985; Zajic and Smith, 1987; Bryant, 1990; Jenneman et al., 1993; Nelson and Schneider, 1993). 사용한 미생물은 Clostridium acetobutylicum이며 6개월 동안 영양물질인 당밀과 함께 주입되었다. 그 결과 오일 회수 증가와 함께 미생물의 생장이 오일의 고유 성분에 영향을 주지 않는 것을 확인하였다. 그 밖에 미국에서 이루어진 한 미생물 회수증진공법에서는 미생물 Clostridium을 당밀과 함께 주입하여 휘발성 산과 이산화탄소를 생성, 예측 생산량 대비 3.5배 증가한 오일 회수율을 얻었다(Yarbrough and Coty, 1983). 이는 바이오산, 이산화탄소, 생계면활성제 생성 등에 따른 복합적 메커니즘 작용에 의한 결과라 보여진다. 또한 미생물이 저류층 내 공극을 차지하면서 고투과층에 따른 접촉효율 문제를 개선했기 때문에 이와 같은 결과가 나타난 것이라 볼 수 있다.
1960년대 러시아 Sernovodek 유전에 미생물공법을 적용하여 그 효과를 확인하였다(Kuznetsov et al., 1963). 연구에 따르면 해당 유전에서 6개월간의 폐정 이후에 정두압이 1.5 atm까지 증가하였으며 오일 생산이 소량 증가했다(Senyukov et al., 1970; Ivanov et al., 1993). Wagner는 러시아의 Tataryia 유전에 미생물공법을 적용하여 그 가능성을 검증하였고, 체코슬로바키아, 폴란드, 루마니아, 헝가리 등 동유럽 4개국이 공동으로 현장 적용을 수행한 사례도 있다(Dostalek and Spurny, 1958; Updegraff, 1990; Wagner et al., 1993).
미생물 생장에 따른 표면장력의 감소를 오일 증산의 원인으로 규명한 실험연구가 진행되었다. 해당 연구는 비록 발표 당시에 많은 비판을 받았지만 체코슬로바키아로부터 비슷한 결과가 후속 보고되면서 그 가능성이 다시 제고되었다(Updegraff, 1990). 또한, 체코슬로바키아에서 수행된 연구에서는 Pseudomonas를 영양물질과 함께 저류층에 주입한 일곱 번 중 세 번의 실험에서 석유 생산량이 증가했다고 보고했다(Dostalek and Spurny, 1958). 이때 영양물질을 주입하지 않은 현장 적용 연구와 비교하여 미생물공법에 의해 6개월 동안 오일 회수율이 약 7% 상승한 것이 검증되었다.
루마니아에서 1971년부터 1982년까지 실시한 많은 현장 적용 실험에서는 단일 미생물 종이 아닌 혼합 미생물 종을 적용하면서 그 가능성을 검증하였다(Lazar, 1998). 지층수 내에 존재하는 미생물과 함께 영양물질을 주입하고 약 8개월 후에 미생물이 생성한 가스, 바이오산, 바이오폴리머 등을 확인했다. 실시된 유정 7개 중 2개에서 오일 회수율 증가가 나타났으며 4개 유정에서는 저투과성 암석, 지나친 고온 환경 등에 의해 그 효과가 나타나지 않았다.
헝가리에서는 혼합된 미생물 종을 주입한 후 8개월에 걸쳐 오일 회수율이 증가하는 결과를 얻었다(Yaranyi, 1968). 이 때 저류층의 투과도가 600에서 700 md인 경우에는 오일 회수율이 증가하는 반면, 투과도가 10에서 70 md인 경우는 오일 회수율 증가가 나타나지 않았다.
한편, 호주의 Alton 유전에서는 미생물의 영양분 조작을 통해 오일 생산량을 증가시키는 연구를 진행하기도 했다(Lazar et al., 2007). 해당 분야는 현재 중국에서 활발하게 이루어지고 있으며, Leuconostoc mesenteroids, Pseudomonas aeruginosa, Xanthomonas campestris와 같이 바이오폴리머를 생성하는 다양한 종을 이용한 연구가 활발하게 이루어지고 있다(Xiang and Xue, 2000).
선택적 공극막힘에 따라 유체 간 유동도가 개선되어 오일회수율이 증가하는 연구는 1958년 네덜란드에서 행해졌다(Von Heningen et al., 1958). 이 연구에서는 고투과도층을 선택적 공극막힘을 이용해 석유 생산을 증가시키는 방법에 대해 규명했다. 이 외에도 아르헨티나, 베네수엘라, 트리니다드-토바고, 노르웨이, 말레이시아 등에서 현장 적용을 통해 미생물 회수증진공법의 가능성을 제시하였다(Bastardo et al., 1993; Maharaj et al., 1993; Maure et al., 1999; Ghazali, 2001; Strappa et al., 2004; Awan et al., 2008; Rassenfoss, 2011).
결론
미생물 회수증진공법은 저류층 내 잔존 오일을 추가로 회수하는데 미생물 및 그 대사산물을 이용하는 기술이다. 지금까지 수많은 실험과 현장 적용을 통해 기술의 성공 가능성을 확인하였다. 미생물공법의 효율성은 각 저류층 환경에서의 오일 점도, 저류층 암석 특성, 저류층 내 존재하는 미생물 군집 등에 의해 영향을 받는다. 다양한 미생물적 기술 적용 전략이 있으나, 비용과 시간, 회수 효율 등과 같은 이유로 현장 적용에는 제한될 수 있다. 미생물공법의 주요 적용 전략은 선택적 공극막힘 현상을 이용하는 방법과 대사산물인 생계면활성제, 바이오폴리머, 바이오산 및 바이오솔벤트 등을 이용하는 방법이 있다. 현재의 미생물공법은 오일의 증산에 기여할 수 있는 친환경적, 경제적인 방안으로 평가받고 있다. 기존 회수증진공법의 완벽한 대체 기술까지는 아니더라도, 기존의 기술을 적용하기에 적합하지 않을 경우 그 기술을 보완할 수 있는 기술로서 적용 가능하다.
향후 미생물공법에 관한 연구는 바이오생성물을 얻기 위한 경제적인 기술 개발과 더불어 시뮬레이션 및 수치 해석 기법을 통한 공법의 최적화 설계를 목표로 한다. 미생물공법을 적용하고자하는 대상 유정의 주변 환경은 모두 다 다르므로 불확실성과 내재적 위험성이 항상 존재한다. 그렇기 때문에 각각의 환경을 고려한 적합한 공법을 선정하기 위해서는 선행 연구가 필수적으로 수행되어야 한다. 회수증진기술로서의 미생물공법의 전망은 밝으며, 생성된 대사산물은 오일 회수 분야를 넘어 다양한 분야에서도 활용 가능하다. 미생물공법은 저유가 시대에서의 오일회수증진을 위한 친환경적 기술이라 할 수 있다.